Brachyterapia HDR raka stercza
Dr hab. n. med. Piotr Wojcieszek
Zakład Brachyterapii, Narodowy Instytut Onkologii im. Marii Skłodowskiej-Curie – Państwowy Instytut Badawczy w Gliwicach
Pacjent z rozpoznanym rakiem stercza ma wiele równorzędnych opcji terapeutycznych do wyboru. Brachyterapia jest jedną z technik leczenia promieniami, która łączy w sobie cechy zabiegowe niewymagające usunięcia gruczołu krokowego, lecz prowadzące do zniszczenia guza nowotworowego poprzez radioablację lub ciągłe napromienianie.
Stworzenie małych źródeł, które można umieścić w sterczu przezkroczowo, pozwoliło na rozwinięcie brachyterapii śródtkankowej. W kolejnych dekadach zaczęto również wykorzystywać nowoczesne metody obrazowania. Najpierw wykorzystywano ultrasonografię przezodbytniczą (ang. TRUS – transrectal ultrasound), która pozwoliła na implantację źródeł w czasie rzeczywistym. Następnie włączono do praktyki tomografię komputerową (TK) oraz rezonans magnetyczny (RM). Dzięki temu brachyterapia śródtkankowa w czasie rzeczywistym stała się nowoczesną i skuteczną metodą leczenia raka stercza.
Technika implantacji
Wykonanie implantu śródtkankowego odbywa się po znieczuleniu podpajeczynówkowym lub ogólnym, w pozycji na plecach z uniesionymi nogami (tzw. pozycja litotomijna), po założeniu cewnika do pęcherza moczowego. Zabieg odbywa się pod kontrolą TRUS umieszczonego w stepperze (Ryc. 1), który jest unieruchomiony i podłączony do stacji planowania leczenia. Pozwala to na precyzyjne pozycjonowanie igieł w przestrzeni.
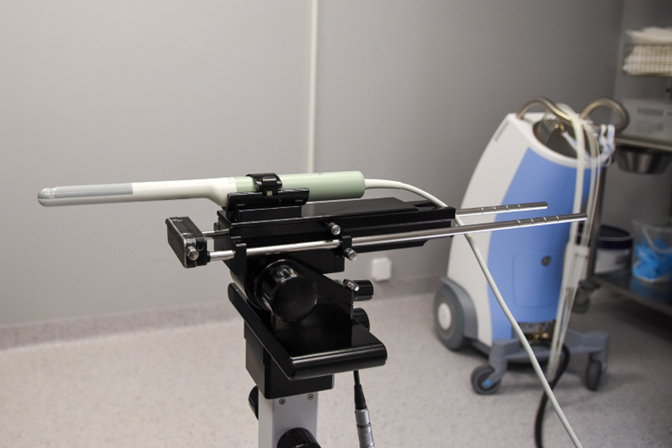
Ryc. 1 Głowica USG przezodbytniczego umieszczona na stepperze.
W pierwszej fazie wykonuje się planowanie przygotowawcze, które ma na celu ustalenie wstępnego układu igieł implantu śródtkankowego w gruczole krokowym. Ułatwia to przeprowadzenie właściwej implantacji, zmniejsza ryzyko błędu geograficznego oraz daje informacje na temat objętości obszaru tarczowego. W niektórych ośrodkach ta część procedury jest pomijana, lecz wymaga to dużego doświadczenia zespołu przeprowadzającego leczenie.
Następnie przygotowywane jest pole operacyjne w obszarze krocza. Do steppera z głowicą TRUS mocowana jest płytka (tzw. template), w której znajdują się otwory oznaczone literami na osi X oraz cyframi arabskimi na osi Y (Ryc. **). Przez otwory w płytce wprowadzane są igły śródtkankowe zgodnie z wcześniejszym planem przygotowawczym, od którego możliwe są odstępstwa. Podczas wykonywania aplikacji należy opierać się o system paryski, czyli zakładanie igieł równolegle do siebie. Pozwala to później na uzyskanie optymalnego rozkładu dawki promieniowania.
Po wkłuciu igieł wykonuje się ponowne obrazowanie TRUS (opcjonalnie TK i/lub RM). Na podstawie uzyskanych obrazów lekarz wykonujący zabieg rysuje obszar tarczowy, który ma być napromieniony (tj. całą prostatę), oraz narządy krytyczne: cewkę moczową, przednią ścianę odbytnicy, balon cewnika i/lub ścianę pęcherza moczowego. Następnie fizyk medyczny planuje ostateczny rozkład dawki, wcześniej wykonując odpowiednie pomiary igieł i ich umiejscowienia. Wykonany plan leczenia jest sprawdzany przez drugiego fizyka oraz akceptowany przez lekarza specjalistę radioterapii onkologicznej.
Kolejnym krokiem jest podłączenie igieł do afterloadera, w którym znajduje się źródło promieniotwórcze, najczęściej iryd-192. Personel zabiegowy opuszcza bunkier terapeutyczny, pacjent jest obserwowany przez tor wizyjny oraz monitorowane są jego czynności życiowe (Ryc. 2). Rozpoczyna się napromienianie, które w każdej chwili można przerwać w razie konieczności. Praca afterloadera jest kierowana przez komputer pod kontrolą technika elektroradiologii. Izotop ma precyzyjnie zaplanowane miejsca i czasy postoju w każdej igle śródtkankowej. Dzięki temu uzyskiwany jest odpowiedni rozkład dawki w każdym procesie leczenia.

Ryc. 2 Sterownia z monitorami do obserwacji pacjenta i jego czynności życiowych.
Zastosowania brachyterapii w leczeniu raka gruczołu krokowego
W przypadku chorych z korzystnym wariantem raka gruczołu krokowego zastosowanie aktywnej obserwacji lub aktywnej terapii jest równorzędne. Zarówno leczenie chirurgiczne oraz napromienianie mają podobną skuteczność, jednak różnią się ewentualnymi powikłaniami. Przy wyborze leczenia należy się kierować możliwościami ośrodka onkologicznego, oczekiwaniami chorego i ewentualnymi następstwami interwencji. U chorych z niskiej grupy ryzyka niepowodzenia leczenia można stosować brachyterapię, zarówno LDR, jak i HDR. Pięcioletnia skuteczność brachyterapii HDR w leczeniu raka gruczołu krokowego wynosi ponad 90%, przy niskiej toksyczności ze strony układu moczowo-płciowego i przewodu pokarmowego.
Chorym z bardziej zaawansowaną chorobą można również zaproponować brachyterapię. Największy zysk terapeutyczny u pacjentów z niekorzystnymi czynnikami rokowniczymi można uzyskać z połączenia teleradioterapii z brachyterapią (tzw. boost).
Wznowa po pierwotnym leczeniu radykalnym
Ratująca brachyterapia HDR ma zastosowanie w leczeniu wznowy miejscowej raka gruczołu krokowego po leczeniu radykalnym, zwłaszcza niepowodzenia po teleradioterapii. Zaleca się, żeby pacjenci byli prowadzeni w ramach prospektywnych badań klinicznych, jednak wiele ośrodków na poziomie eksperckim wykonuje takie procedury.
Dawkowanie
Dawka promieniowania jonizującego powinna uwzględniać prawdopodobieństwo wyleczenia miejscowego oraz ryzyko toksyczności. W brachyterapii HDR nie ma wystarczających dowodów naukowych na wybranie odpowiedniego schematu monoterapii. Najczęściej używany schemat to 13–15 Gy podany w trakcie jednego procesu leczenia do dawki całkowitej 26–28 Gy (dwa procesy leczenia) w odstępie 7–14 dni. Przy połączeniu teleradioterapii z brachyterapią HDR rekomendowana dawka z brachyterapii wynosi 15 Gy. Dla brachyterapii ratującej nie ma rekomendacji odnośnie dawkowania.
Podsumowanie
Brachyterapia w połączeniu z nowoczesną diagnostyką i obrazowaniem stanowi atrakcyjną opcję dla chorych na raka stercza. Krótkie leczenie, małe objętości napromienianych narządów krytycznych oraz szeroki wachlarz wskazań stanowią istotne uzupełnienie między radykalną prostatektomią a napromienianiem z wiązek zewnętrznych. Dostępne dane z analiz naukowych wskazują na potencjał tkwiący w tej metodzie, zwłaszcza u chorych z niekorzystnymi czynnikami rokowniczymi lub wznową miejscową raka stercza.





